Hoe Bereken Je De Molaire Massa: Een Stap-Voor-Stap Gids
Molaire Massa
Keywords searched by users: hoe bereken je de molaire massa hoe bereken je de relatieve molecuulmassa, wat is molaire massa, hoe bereken je mol, molaire massa eenheid, molaire massa berekenen formule, molaire massa h, molaire massa c, molaire massa periodiek systeem
Wat is molaire massa?
Molaire massa verwijst naar de massa van één mol van een stof. Het is een belangrijke eigenschap in de scheikunde en wordt gebruikt bij het uitvoeren van verschillende berekeningen. Molaire massa wordt uitgedrukt in gram per mol (g/mol) en kan worden berekend aan de hand van de atoommassa’s van de elementen waaruit een verbinding bestaat. Door de molaire massa te kennen, kunnen chemici belangrijke informatie afleiden, zoals het aantal deeltjes in een monster, het aantal mol en de massa van een monster.
Hoe kun je molaire massa berekenen?
Het berekenen van de molaire massa van een verbinding kan worden gedaan aan de hand van verschillende stappen. Hieronder vind je een stapsgewijze handleiding om je te helpen bij het berekenen van de molaire massa.
Stap 1: Het chemische element identificeren
Om de molaire massa van een verbinding te kunnen berekenen, moet je eerst de chemische formule van de verbinding kennen. Identificeer de elementen die in de verbinding voorkomen en noteer ze.
Stap 2: De atoommassa van elk element vinden
Zoek de atoommassa van elk element op dat in de chemische formule voorkomt. De atoommassa is te vinden in het periodiek systeem der elementen en wordt uitgedrukt in atomaire massa-eenheden (u).
Stap 3: Het aantal atomen van elk element bepalen
Bepaal het aantal atomen van elk element in de chemische formule. Het aantal atomen is te vinden in de subscripten die naast de elementsymbolen staan. Deze subscripten geven aan hoeveel atomen er van elk element aanwezig zijn in de verbinding.
Stap 4: Vermenigvuldig de atoommassa met het aantal atomen
Vermenigvuldig de atoommassa van elk element met het aantal atomen ervan in de verbinding. Dit geeft je de massa van elk element binnen één mol van de verbinding.
Stap 5: De molmassa van elk element berekenen
De molmassa van elk element wordt berekend door de massa van elk element binnen één mol van de verbinding te delen door het aantal atomen van dat element in één mol van de verbinding.
Stap 6: Optellen van de molmassa’s van alle elementen
Tel de molmassa’s van alle elementen bij elkaar op om de molaire massa van de verbinding te berekenen. Dit geeft je de massa van één mol van de verbinding in gram per mol (g/mol).
Extra tips voor het berekenen van molaire massa
– Om de molaire massa van een element te bepalen, hoef je alleen de atoommassa van dat element te kennen.
– Zorg ervoor dat je de juiste atoommassa’s gebruikt voor elk element, omdat deze variëren afhankelijk van isotopen.
– Weet dat de molaire massa van een verbinding kan variëren, afhankelijk van de samenstelling en de structuur van de verbinding.
– Controleer altijd je berekeningen om fouten te voorkomen.
Veelgestelde vragen (FAQ)
Wat is de relatieve molecuulmassa?
De relatieve molecuulmassa is een andere term die soms wordt gebruikt om naar de molaire massa van een verbinding te verwijzen. Ze verwijzen naar dezelfde eigenschap, namelijk de massa van één mol van een verbinding.
Wat is molaire massa?
Molaire massa is de massa van één mol van een substantie en wordt uitgedrukt in gram per mol (g/mol). Het geeft de verhouding weer tussen de massa van een monster en het aantal deeltjes dat daarin aanwezig is. Molaire massa wordt gebruikt bij het uitvoeren van verschillende berekeningen in de scheikunde.
Hoe bereken je mol?
Om het aantal mol te berekenen, deel je de massa van een monster door de molaire massa van de stof. Dit geeft je het aantal mol van de stof in het monster. De formule om het aantal mol te berekenen is:
Aantal mol = Massa (g) / Molaire massa (g/mol)
Wat is de eenheid van molaire massa?
Molaire massa wordt uitgedrukt in gram per mol (g/mol). Het combineert de eenheden van massa (gram) en het aantal deeltjes (mol).
Wat is de formule om molaire massa te berekenen?
De formule om molaire massa te berekenen is:
Molaire massa = (Massa element 1 x Aantal atomen element 1) + (Massa element 2 x Aantal atomen element 2) + …
Deze formule is gebaseerd op het optellen van de massa’s van elk element binnen één mol van de verbinding.
Wat is de molaire massa van waterstof (H)?
De molaire massa van waterstof (H) is ongeveer 1,00784 gram per mol (g/mol).
Wat is de molaire massa van koolstof (C)?
De molaire massa van koolstof (C) is ongeveer 12,0107 gram per mol (g/mol).
Waar kan ik de molaire massa van een element vinden in het periodiek systeem?
De molaire massa van een element is te vinden onder het symbool van het element in het periodiek systeem der elementen. Het wordt vaak weergegeven met één of twee decimalen, omdat het rekening houdt met de verschillende isotopen van dat element.
Met behulp van deze informatie kun je de molaire massa van elke verbinding berekenen. Het begrijpen van de berekening van molaire massa is essentieel voor het uitvoeren van chemische berekeningen en het begrijpen van de samenstelling van verschillende stoffen.
Categories: Delen 46 Hoe Bereken Je De Molaire Massa

Hoe Bereken Je De Relatieve Molecuulmassa
In de scheikunde is het concept van de relatieve molecuulmassa van groot belang. Het stelt ons in staat om de massa van een molecuul te berekenen op basis van de massa van de atomen waaruit het is samengesteld. Deze informatie is essentieel bij het begrijpen van chemische reacties en het uitvoeren van berekeningen in de laboratoriumomgeving.
Dit artikel is bedoeld als een gedetailleerde gids voor het berekenen van de relatieve molecuulmassa. We zullen specifieke concepten uitleggen en stapsgewijze instructies geven om je te helpen dit proces te begrijpen en toe te passen. Laten we beginnen!
Wat is de relatieve molecuulmassa?
De relatieve molecuulmassa, ook wel de molaire massa genoemd, is de massa van een molecuul uitgedrukt in atomaire massa-eenheden (amu). Het wordt berekend door de massa van elk atoom in het molecuul op te tellen. De eenheid voor het uitdrukken van de molaire massa is gram per mol (g/mol).
Bijvoorbeeld, in water (H2O) bestaat het molecuul uit twee waterstofatomen (H) en één zuurstofatoom (O). De atoommassa van waterstof is ongeveer 1,01 amu en de atoommassa van zuurstof is ongeveer 16,00 amu. Om de molaire massa van water te berekenen, moeten we deze twee waarden optellen:
(2 x 1,01 amu) + (1 x 16,00 amu) = 18,02 amu
Dus de relatieve molecuulmassa van water is ongeveer 18,02 g/mol.
Waarom is de relatieve molecuulmassa belangrijk?
De relatieve molecuulmassa speelt een cruciale rol in de chemie. Het stelt ons in staat om de hoeveelheid stof (hoeveelheid) in een monster te kwantificeren en om te rekenen tussen massa, het aantal deeltjes en het volume van stoffen. Het is belangrijk bij het bepalen van de juiste verhoudingen tussen verschillende reagentia in chemische reacties en bij het begrijpen van de resultaten van fysische en chemische analyses.
Berekening van de relatieve molecuulmassa
Het berekenen van de relatieve molecuulmassa kan als volgt worden gedaan:
Stap 1: Identificeer de elementen en hun respectieve atoomaantallen in het molecuul.
Stap 2: Zoek de atoommassa van elk element op in het periodiek systeem der elementen. De atoommassa-eenheden worden meestal gegeven in amu.
Stap 3: Vermenigvuldig de atoommassa van elk element met het aantal atomen in het molecuul en tel deze waarden bij elkaar op.
Stap 4: Rond de verkregen waarde af tot het juiste aantal significante cijfers, indien nodig.
FAQs
1. Wat is het verschil tussen atoommassa en relatieve molecuulmassa?
De atoommassa verwijst naar de massa van een enkel atoom, terwijl de relatieve molecuulmassa de massa van een volledig molecuul is.
2. Hoe bereken ik de relatieve molecuulmassa van een ionisch molecuul?
Voor ionische verbindingen, zoals natriumchloride (NaCl), moet je de positieve en negatieve ionen afzonderlijk behandelen. Bereken eerst de molaire massa van het positieve ion en het negatieve ion en tel daarna de waarden op.
3. Welke eenheid wordt gebruikt om de relatieve molecuulmassa uit te drukken?
De relatieve molecuulmassa wordt uitgedrukt in gram per mol (g/mol).
4. Zijn er uitzonderingen op het berekenen van de relatieve molecuulmassa?
Ja, sommige moleculen bevatten isotopen, die varianten zijn van een specifiek element met een iets andere atoommassa. In dat geval moet je rekening houden met de verhouding van de isotopen bij het berekenen van de molaire massa.
5. Zijn er online tools beschikbaar om de relatieve molecuulmassa te berekenen?
Ja, er zijn verschillende online moleculaire massa-calculators beschikbaar. Deze tools vereenvoudigen het berekeningsproces door automatisch de atoommassa’s en het aantal atomen in het molecuul te verwerken.
Conclusie
De berekening van de relatieve molecuulmassa is een fundamenteel concept in de scheikunde. Het stelt ons in staat om de massa van een molecuul te bepalen op basis van de massa van de atomen waaruit het is samengesteld. Door de stappen in dit artikel te volgen, kun je de molaire massa van een molecuul nauwkeurig berekenen. Dit is essentiële informatie voor het begrijpen van chemische eigenschappen, reacties en berekeningen in het laboratorium.
Referentie:
– “Molaire massa” (Wikipedia)
– “Molaire massa berekenen: 6 stappen” (wikiHow)
– “Molmassa berekenen” (Natuurkunde.nl)
– “Wat is mol en hoe kun je hiermee rekenen?” (Mr. Chadd)
– “De Mol: Wat Is Het en Hoe Reken Je Ermee? (Uitleg)” (ExamenOverzicht.nl)
– “Scheikunde – Molaire massa – Wetenschap” (Wetenschap.info)
Wat Is Molaire Massa
In de wereld van de scheikunde zijn er veel concepten en termen die soms verwarrend kunnen zijn. Een van die termen is “molaire massa.” Als je je ooit hebt afgevraagd wat molaire massa is en hoe het wordt berekend, ben je hier aan het juiste adres. Deze diepgaande gids zal al je vragen beantwoorden en je een duidelijk inzicht geven in dit belangrijke concept.
Wat is molaire massa?
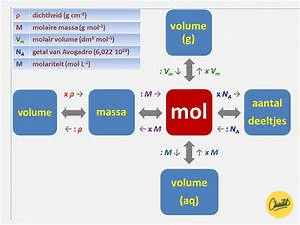
Molaire massa, ook wel molmassa genoemd, is een begrip dat wordt gebruikt in de scheikunde om de massa van een bepaalde stof aan te geven. Het vertelt ons hoeveel gram van een stof er aanwezig is in één mol van die stof. Een mol staat gelijk aan 6,022 x 10^23 deeltjes.
Molaire massa wordt uitgedrukt in gram per mol (g/mol) en wordt vaak gebruikt bij het uitvoeren van berekeningen, zoals het bepalen van de hoeveelheid stof die nodig is om een chemische reactie te laten plaatsvinden.
Hoe wordt molaire massa berekend?
Molaire massa kan worden berekend door de atoommassa’s van de elementen in een chemische formule op te tellen. De atoommassa van een element is de gemiddelde massa van één atoom van dat element, uitgedrukt in atomaire massa-eenheden (u).
Laten we eens kijken naar een voorbeeld om het berekenen van de molaire massa te verduidelijken. We zullen water (H2O) als ons voorbeeld gebruiken. De chemische formule van water geeft aan dat het bestaat uit twee waterstofatomen (H) en één zuurstofatoom (O).
De atoommassa van waterstof is ongeveer 1,00784 u, terwijl de atoommassa van zuurstof ongeveer 15,999 u is. Nu kunnen we de molaire massa van water berekenen door deze getallen op te tellen:
Molaire massa van water = (2 x atoommassa van waterstof) + (1 x atoommassa van zuurstof)
= (2 x 1,00784 u) + (1 x 15,999 u)
= 2,01568 u + 15,999 u
= 18,01568 u
Dus de molaire massa van water is ongeveer 18,01568 g/mol.
Nu je weet hoe je de molaire massa kunt berekenen, kun je dit concept toepassen op andere chemische stoffen en hun molaire massa bepalen.
Waarom is molaire massa belangrijk?
Molaire massa is een belangrijk concept in de scheikunde omdat het ons helpt bij het uitvoeren van verschillende berekeningen, zoals het bepalen van de hoeveelheid stof die nodig is voor een bepaalde reactie, het omrekenen van massa naar aantal deeltjes en vice versa, en het berekenen van de massa van producten en reactanten in chemische reacties.
Bovendien biedt de molaire massa informatie over de samenstelling van een stof en kan het gebruikt worden om de relatieve hoeveelheden van verschillende elementen in een verbinding te bepalen. Dit stelt scheikundigen in staat om de exacte verhoudingen te begrijpen waarin elementen met elkaar reageren en om nauwkeurige voorspellingen te doen over reacties en hun resultaten.
Molaire massa in het dagelijks leven
Hoewel molaire massa een term is die voornamelijk wordt gebruikt in de scheikunde, heeft het ook toepassingen in het dagelijks leven. Bijvoorbeeld, in de voedingsmiddelenindustrie wordt molaire massa gebruikt om de hoeveelheid voedingsstoffen in voedsel te berekenen. Het helpt bij het bepalen van de exacte hoeveelheid calorieën, vetten, koolhydraten en eiwitten in een bepaalde hoeveelheid voedsel.
In de farmaceutische industrie speelt molaire massa ook een belangrijke rol bij het berekenen van de juiste dosering van geneesmiddelen en het begrijpen van de effecten van geneesmiddelen op het lichaam.
FAQs
1. Wat is het verschil tussen molaire massa en atoommassa?
Atoommassa is de massa van één atoom van een element, uitgedrukt in atomaire massa-eenheden (u). Molaire massa daarentegen is de massa van één mol van een stof en wordt uitgedrukt in gram per mol (g/mol). Molaire massa kan worden berekend door de atoommassa van de elementen in een stof op te tellen.
2. Wat is het verschil tussen molaire massa en moleculaire massa?
Moleculaire massa is de som van de atoommassa’s van alle atomen in een molecule. Het wordt gebruikt om de massa van een specifieke moleculaire verbinding aan te geven. Molaire massa daarentegen is de massa van één mol van een stof en kan worden berekend door de atoommassa’s van de elementen in de stof op te tellen.
3. Waarom is het belangrijk om de molaire massa te kennen?
Het kennen van de molaire massa is belangrijk omdat het ons helpt bij het uitvoeren van verschillende chemische berekeningen, zoals het bepalen van de hoeveelheid stof die nodig is voor een reactie, het omrekenen van massa naar aantal deeltjes, en het berekenen van de massa van producten en reactanten. Daarnaast geeft de molaire massa informatie over de samenstelling van een stof en kunnen hierdoor voorspellingen worden gedaan over reacties en hun resultaten.
4. Hoe wordt molaire massa gebruikt in de chemische industrie?
In de chemische industrie wordt molaire massa gebruikt bij het formuleren en produceren van chemische stoffen. Het helpt bij het bepalen van de juiste hoeveelheden grondstoffen die nodig zijn om een bepaald product te maken en het garanderen van de kwaliteit en consistentie van de producten.
5. Hoe wordt de molaire massa gemeten in het laboratorium?
De molaire massa kan worden gemeten in het laboratorium door gebruik te maken van verschillende analytische technieken, zoals massaspectrometrie, chromatografie en kernspinresonantie. Deze technieken stellen onderzoekers in staat om de massa van een stof nauwkeurig te bepalen en zo de molaire massa te berekenen.
Conclusie
Molaire massa is een essentieel concept in de scheikunde dat ons helpt bij het begrijpen van de massa van een stof en het uitvoeren van diverse berekeningen. Het berekenen van de molaire massa vereist het optellen van de atoommassa’s van de elementen in een bepaalde stof. Door de molaire massa te kennen, kunnen chemici nauwkeurige berekeningen maken en voorspellingen doen over chemische reacties.
Of je nu een student bent die zijn kennis van scheikunde wil vergroten of gewoon geïnteresseerd bent in het begrijpen van de wereld om ons heen, het kennen van de molaire massa is een belangrijke stap. Het stelt ons in staat om het gedrag van stoffen beter te begrijpen en om chemische reacties op een effectieve en betrouwbare manier te beheersen.
Hoe Bereken Je Mol
Inleiding
Scheikunde is een boeiend onderwerp dat zich bezighoudt met de eigenschappen, structuur en interacties van materie. Een van de fundamentele concepten in de scheikunde is de “mol”, een eenheid die wordt gebruikt om de hoeveelheid van een stof uit te drukken. Het berekenen van de mol kan aanvankelijk verwarrend lijken, maar met een goed begrip van de principes en formules, kun je het gemakkelijk leren. In dit artikel zullen we dieper ingaan op het onderwerp “hoe bereken je mol” en je voorzien van een gedetailleerde gids om je te helpen begrijpen hoe deze berekeningen worden gemaakt.
Wat is een Mol?
Voordat we ingaan op het berekenen van de mol, is het belangrijk om te begrijpen wat een mol precies is. Een mol is een maateenheid in de scheikunde die wordt gebruikt om de hoeveelheid van een bepaalde stof uit te drukken. Het staat voor een vast aantal deeltjes, vergelijkbaar met hoe een dozijn verwijst naar een specifiek aantal (12).
Een mol van een stof bevat Avogadro’s getal aan deeltjes, dat is ongeveer 6,022 × 10^23. Deze deeltjes kunnen atomen, moleculen, ionen of elektronen zijn, afhankelijk van het type stof waarmee je werkt. Door de hoeveelheid stof in termen van mol uit te drukken, kunnen wetenschappers gemakkelijker vergelijkingen opstellen en chemische reacties analyseren.
Hoe Bereken je Mol: Stapsgewijze Gids
Om de mol van een stof te berekenen, zijn er een aantal formules en stappen die je kunt volgen. Hier is een stapsgewijze gids om je te helpen begrijpen hoe je mol berekent:
Stap 1: Identificeer de stof
Begin met het identificeren van de specifieke stof waarvoor je de mol wilt berekenen. Zorg ervoor dat je de chemische formule van de stof kent.
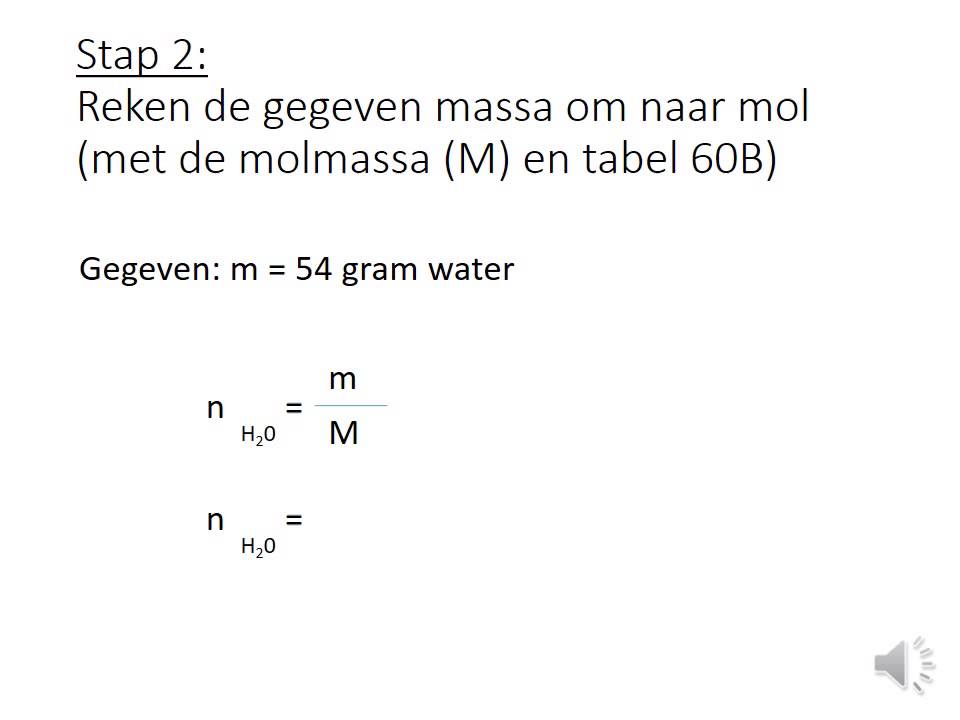
Stap 2: Vind de molaire massa
De molaire massa van een stof is de massa van één mol van die stof, uitgedrukt in grammen per mol (g/mol). Om de molaire massa te vinden, moet je de atoommassa’s van alle elementen in de chemische formule optellen.
Voorbeeld: Laten we de molaire massa van water (H2O) berekenen.
De atoommassa van waterstof (H) is ongeveer 1 gram per mol en de atoommassa van zuurstof (O) is ongeveer 16 gram per mol. Dus de molaire massa van water (H2O) is 2 * 1 + 16 = 18 gram per mol.
Stap 3: Bepaal de massa of het aantal deeltjes
Om de mol te berekenen, heb je de massa van de stof of het aantal deeltjes van de stof nodig. Dit kan worden gegeven in grammen, kilogrammen, milligrammen of deeltjes, afhankelijk van de context.
Stap 4: Kies de juiste formule
Nu is het tijd om de juiste formule te kiezen op basis van de gegeven informatie:
Voor het berekenen van mol met behulp van massa, gebruik je de formule: mol = massa / molaire massa.
Voor het berekenen van mol met behulp van het aantal deeltjes, gebruik je de formule: mol = aantal deeltjes / Avogadro’s getal.
Stap 5: Bereken de mol
Met behulp van de formule die het beste bij je gegevens past, kun je nu de mol berekenen. Zorg ervoor dat je de eenheden in acht neemt en ze indien nodig aanpast.
Stap 6: Interpretatie van het resultaat
Het uiteindelijke resultaat geeft je de hoeveelheid stof uitgedrukt in mol. Dit getal vertelt je het aantal mol van de specifieke stof dat aanwezig is in de gegeven massa of het aantal deeltjes.
FAQ
Hier zijn enkele veelgestelde vragen over het berekenen van mol:
1. Wat is het verschil tussen molaire massa en atoommassa?
– De molaire massa is de massa van één mol van een stof, terwijl de atoommassa de massa is van één enkel atoom of molecuul. De molaire massa wordt berekend door de atoommassa’s van alle elementen in een chemische formule op te tellen.
2. Waarom is het berekenen van mol belangrijk?
– Het berekenen van mol is belangrijk omdat het ons helpt de hoeveelheid stof in een monster te kwantificeren. Dit is essentieel voor het begrijpen van chemische reacties, het maken van oplossingen en het analyseren van de samenstelling van verbindingen.
3. Kan ik het aantal deeltjes direct berekenen zonder mol?
– Ja, je kunt het aantal deeltjes direct berekenen zonder de tussenstap van mol te gebruiken. Je kunt de formule: aantal deeltjes = mol * Avogadro’s getal gebruiken om het aantal deeltjes te berekenen.
Conclusie
Het berekenen van mol is een essentiële vaardigheid in de scheikunde. Door het begrijpen van de principes en het volgen van de stappen die in dit artikel worden beschreven, kun je gemakkelijk de mol van een stof berekenen. Het kennen van de mol is van cruciaal belang bij het analyseren van chemische reacties en het begrijpen van de samenstelling van verbindingen. We hopen dat deze diepgaande gids je heeft geholpen om het concept van het berekenen van mol beter te begrijpen.
Referentiematerialen:
– [Molaire massa](https://nl.wikipedia.org/wiki/Molaire_massa)
– [Molaire massa berekenen: 6 stappen](https://nl.wikihow.com/Molaire-massa-berekenen)
– [Molmassa berekenen](https://www.natuurkunde.nl/vraagbaak/12781/molmassa-berekenen)
– [Wat is mol en hoe kun je hiermee rekenen?](https://www.mrchadd.nl/academy/vakken/scheikunde/rekenen-met-mol-wat-is-mol-en-hoe-kun-je-hier-mee-rekenen)
– [De Mol: Wat Is Het en Hoe Reken Je Ermee? (Uitleg)](https://www.examenoverzicht.nl/scheikunde/de-mol)
– [Scheikunde – Molaire massa – Wetenschap](https://wetenschap.infonu.nl/scheikunde/167472-scheikunde-molaire-massa.html)
Details 13 hoe bereken je de molaire massa






See more here: b1.brokengroundgame.com
Learn more about the topic hoe bereken je de molaire massa.
- Molaire massa
- Molaire massa berekenen: 6 stappen (met afbeeldingen)
- molmassa berekenen
- Wat is mol en hoe kun je hier mee rekenen?
- De Mol: Wat Is Het en Hoe Reken Je Ermee? (Uitleg)
- Scheikunde – Molaire massa – Wetenschap
See more: https://b1.brokengroundgame.com/sport/

